Mechanismus des bakteriellen Kollagenabbaus
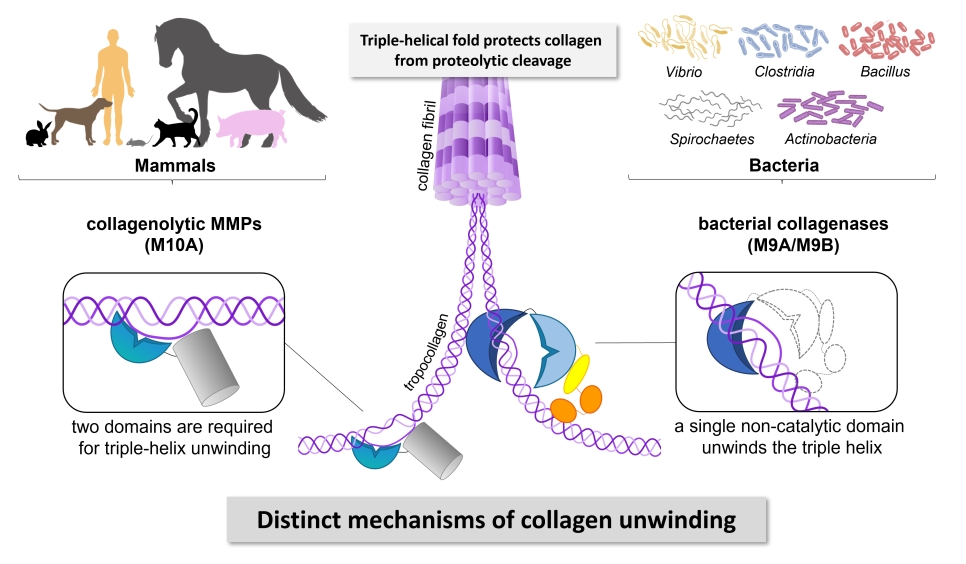
Die extrazelluläre Matrix (ECM) stellt eine erste kritische Verteidigungslinie des angeborenen Immunsystems gegen Infektionen bei Menschen und anderen Säugetieren dar. Kollagene bilden die Grundpfeiler- und mauern der ECM bei Säugetieren. Sie gewährleisten die Integrität aller Gewebe. Kollagene sind die in Säugern am häufigsten vorkommenden und langlebigsten Proteine. Sie sind beinahe immun gegen die enzymatische Spaltung durch Proteasen. Kollagenremodellierung erfolgt nur durch ganz bestimmte körpereigene Kollagenasen und nur an wenigen spezifischen Stellen, und wird streng reguliert.
Um in Gewebe eindringen zu können, müssen die meisten Krankheitserreger die ECM-Barrieren überwinden. Zu diesem Zweck sezernieren einige menschliche Krankheitserreger wie Hathewaya histolytica, Clostridium botulinum, Vibrio vulnificus oder Leptospira interrogans bakterielle Kollagenasen, die das Kollagengerüst der ECM angreifen. Anders als die körpereigenen Kollagenasen können bakteriellen Kollagenasen Kollagen an vielen Stellen radikal in kleine Peptide zerlegen. Dadurch können die Krankheitserreger leichter in die Gewebe eindringen und sich dort ausbreiten. Es kommt zu vermehrter Gewebsnekrose und Diffusion bakterieller Toxine, wodurch die Infektion und Besiedlung des Wirtes erleichtert wird.
Wie bakterielle Kollagenasen es schaffen, fibrilläres Kollagen, das multihierarchisch organisiert ist (Fasern, Fibrillen, Tropokollagen, Gelatine), abzubauen, ist noch nicht gut verstanden. In einem ersten wichtigen Schritt konnten wir den enzymatischen Kern der bakteriellen Kollagenasen, der für den Kollagenabbau erforderlich ist, identifizieren und charakterisieren, die Kollagenaseeinheit (CU). Die CU ist ein Zwei-Domänen-Modul innerhalb des Multidomänenenzyms, das aus der Aktivatordomäne (AD) und der Peptidasedomäne (PD) besteht. Die CU kann tripelhelikal gefaltenes Kollagen in vitro ohne die Hilfe seiner zusätzlichen C-terminalen Domänen spalten.1
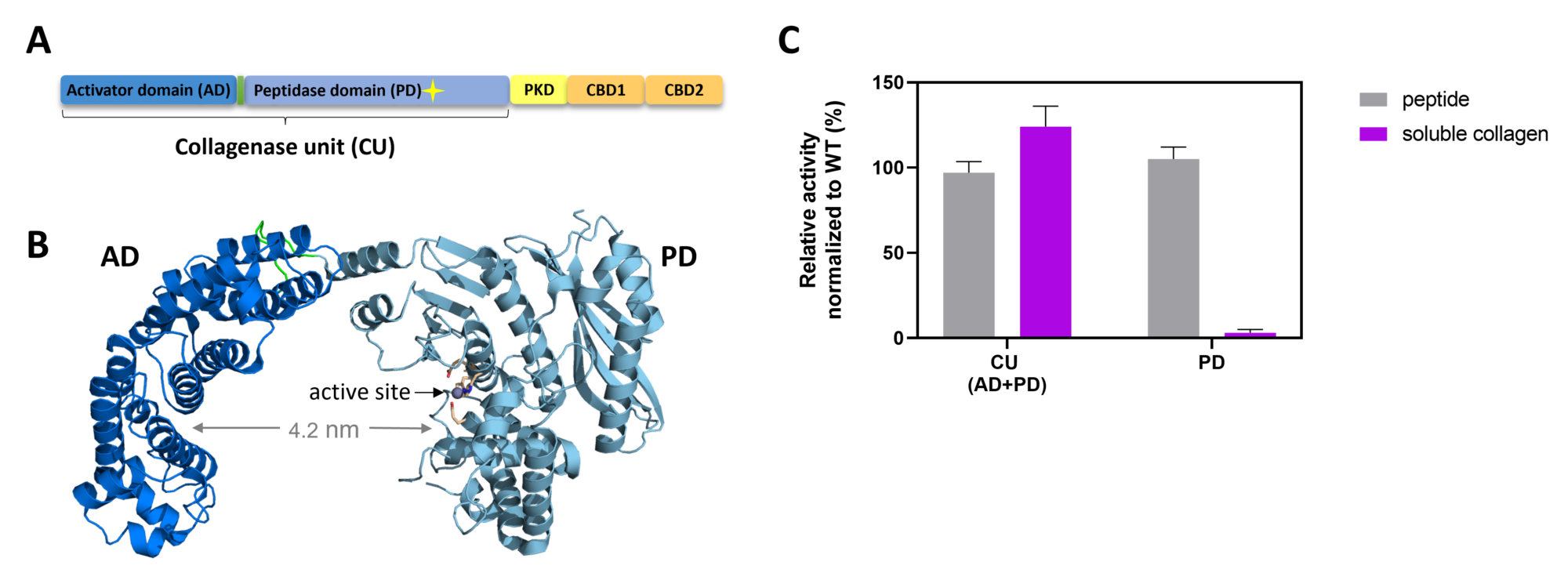
Bakterielle Kollagenasen haben differenzierte Mechanismen entwickelt, um die verschiedenen Erscheinungsformen von Kollagen (fibrilläres vs. lösliches Kollagen) zu prozessieren; z.B. sind für die Spaltung von fibrillärem Kollagen Interdomänenbewegungen zwischen der AD und PD entscheidend. Wir konnten demonstrieren, dass bakterielle Kollagenasen spezifische Mechanismen zur Bindung und Entfaltung von Kollagen nutzen, die sich von den Mechanismen von humanen Kollagenasen wie z.B. die Matrixmetalloprotease 1 (MMP-1) klar unterscheiden. Insbesondere konnten wir zeigen, dass die als nicht-katalytisch angesehene Aktivatordomäne in bakteriellen Kollagenasen das Kollagen lokal entfaltet und dann das entfaltene Substrat direkt der hydrolytischen Peptidasedomäne zur Spaltung präsentiert. D.h. die Aktivatordomäne in bakteriellen Kollagenasen kann Kollagen im Alleingang entwinden, wohingegen die Kollagenentfaltung bei MMPs nur mittels zweier Domänen erfolgen kann.2
Darüberhinaus identifizierten wir kritische Aminosäuren für die Bindung und Entfaltung von Kollagen in einer Exosite der AD.2 Diese Exosite stellt ein neues interessantes Target in der Wirkstoffforschung dar, da es die Entwicklung sehr selektiver Inhibitoren ermöglichen könnte, was in der medizinischen Applikation bei der Behandlung von Infektionskrankheiten zu weniger Nebenwirkungen führen würde.
Entwicklung von maßgeschneiderte Kollagenasen
Aufgrund ihrer hohen kollagenolytischen Aktivität sind die bakteriellen Kollagenasen ColG und ColH aus Hathewaya histolytica (ehemals Clostridium histolyticum) bereits vielfach in der Industrie, Forschung und in Klinik in Verwendung. Sie werden z.B. routinemäßig für die Isolierung von Zellen aus einer unterschiedlichen Primärgeweben zu Forschungs- und Transplantationszwecken verwendet. In der Klinik werden diese Enzyme zur Wundreinigung und zur Behandlung der Dupuytren’schen Kontraktur und der Peyronie’schen Krankheit eingesetzt.3–6
Unser vertieftes Verständnis der mechanistischen Details der Kollagenprozessierung durch bakterielle Kollagenasen, d. h. die Entschlüsselung der minimalen Einheiten, die für die spezifische Substratbindung, -entfaltung und -spaltung erforderlich sind, und das Verständnis dafür, wie die Domänendynamik den Kollagenumsatz beeinflusst, haben die Grundlagen für die zukünftige Entwicklung maßgeschneiderter Kollagenasen mit noch nie dagewesener Spezifität geschaffen.
Entwicklung selektiver, auf das aktive Zentrum gerichteter Inhibitoren
In Zusammenarbeit mit dem Helmholtz-Institut für Pharmazeutische Forschung Saarland (HIPS) und der Pharmazeutischen und Medizinischen Chemie der Universität des Saarlandes (beide Saarbrücken, Deutschland) arbeiten wir am strukturbasierten Design und der Synthese von potenten und selektiven Inhibitoren von clostridialen Kollagenasen. Unser Ziel ist es, biologisch potente Verbindungen für die zukünftige Entwicklung antivirulenter Wirkstoffkandidaten zu entwickeln.

Link zu unseren Publikationen!
Referenzen
- Eckhard, U., Schönauer, E., Nüss, D. & Brandstetter, H. Structure of collagenase G reveals a chew-and-digest mechanism of bacterial collagenolysis. Nat Struct Mol Biol 18, 1109–1114 (2010). https://www.nature.com/articles/nsmb.2127
- Serwanja, J., Wieland, A. C., Haubenhofer, A., Brandstetter, H. & Schönauer, E. A conserved strategy to attack collagen: The activator domain in bacterial collagenases unwinds triple-helical collagen. Proceedings of the National Academy of Sciences 121, e2321002121 (2024). https://www.pnas.org/doi/10.1073/pnas.2321002121
- Patry, J. & Blanchette, V. Enzymatic debridement with collagenase in wounds and ulcers: a systematic review and meta‐analysis. Int Wound J 14, 1055 (2017).
- Sandler, A. B. et al. Treatment of Dupuytren’s Contracture With Collagenase: A Systematic Review. Hand (N Y) 17, 815–824 (2022).
- Gaffney, C. D. & Kashanian, J. A. Peyronie Disease. JAMA 324, 2566–2566 (2020).
- Ishii, K., Suzuki, N., Mabuchi, Y., Sekiya, I. & Akazawa, C. Technical advantage of recombinant collagenase for isolation of muscle stem cells. Regen Ther 7, 1–7 (2017).
- Schönauer, E. et al. Discovery of a Potent Inhibitor Class with High Selectivity toward Clostridial Collagenases. J Am Chem Soc 139, 12696–12703 (2017). https://pubs.acs.org/doi/full/10.1021/jacs.7b06935




